重庆大学化学化工学院李葆生教授课题组致力于氮杂活性分子的高效合成,近年来在该领域取得了一系列重要研究成果。近期,该组在氮杂多环化合物的合成领域取得突破进展,其成果以“Divergent access to 5,6,7-perifused cycles”为题在Nat. Commun.上发表(doi.org/10.1038/s41467-023-40801-0)。重庆大学为唯一通讯单位,李葆生教授为通讯作者,2020级博士生韩儆鹏为第一作者。
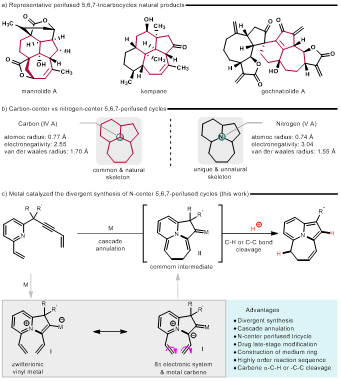
图1.背景与设想
5,6,7-稠三环结构是许多生物活性天然产物的核心骨架,常被用作药物设计或寻找活性分子先导结构(图1a)。由于较强的电负性以及较小的原子半径,氮原子将增加分子的极性及水溶性,提高分子可利用度。然而,当氮原子位于稠周环的中心位置时,价态以及非键电子对的存在将极大增加合成难度。特别是存在七元环时,角张力、不利的熵以及焓等因素使其合成极具挑战(图1b)。亟需发展新方法来解决合成氮中心-5,6,7-稠三环化合物的难题。
基于此,李葆生课题组以吡啶烯炔为底物,在金属催化下发生5-endo环化生成两性离子中间体,随后以8π电环化生成三环卡宾中间体,进而触发随后的a-C-H或C-C键断裂,从而实现氮中心-5,6,7-稠三环化合物多样性合成(图1c)。当杂环作为π组分参与反应时,例如噻吩、呋喃、吲哚等,亦可高效合成一系列具有氮中心-5,6,7-骨架的多环化合物(图2)。
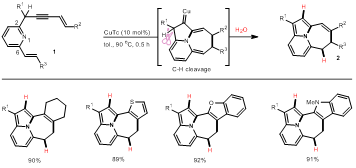
图2.a-C-H键断裂底物范围
归因于三元环的角张力,作者推测当底物的炔丙位是三元环时,有可能发生金属卡宾的a-C-C键断裂,从而进一步的亲核取代。通过深入的研究发现,以醋酸钠作为亲核试剂,在磷酸银的催化下可实现卡宾诱导的亲核开环反应。类似地,不同的杂环作为π组分均能以优良的产率得到四环或五环的氮中心-5,6,7-稠三环化合物。不同类型的亲核试剂(如氧、硫、氮、碳等)均具有良好的兼容性。
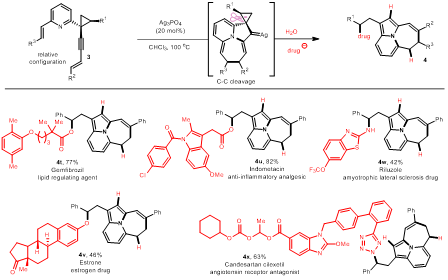
图3.a-C-C键断裂在药物分子后期修饰中的应用
作者利用该反应对复杂的药物分子进行了后期修饰(图4)。实验结果表明,含氧、氮、碳等亲核位点的药物分子均能兼容复杂的反应体系,并能以良好的产率得到目标产物,其结构进一步证实该方法在药物研发中的实用性。此外,该策略具有高效性、原子经济性、产物多样性等特征,有利于推动相关类型药物及活性化合物的研发。
小结:
李葆生课题组发展了一种高效的串联环化反应实现了氮中心-5,6,7-稠三环化合物的多样性合成。该策略以铜或银为催化剂,8π电环化反应为关键步骤,氮中心的三环卡宾物种为核心中间体。其中不同类型的烯烃或杂芳环作为π组分均可以参与电环化反应,高效地合成结构新颖的四环或者五环骨架。该方法学的实用性也通过药物分子的后期修饰及合成转化得以证实。研究工作得到了国家自然科学基金 (Grant 21772019),重庆创新创业支持计划(cx2019007 and cx2020047),重庆市自然科学基金(CSTB2022NSCQ-MSX0320)等项目的支持。